ABOUT US
企業情報

企業理念
当社は、「SLCトランスポーター創薬の新たな可能性を追求し、グローバルベンチャーとして世界中の人々が抱えるアンメット・メディカル・ニーズに応える革新的新薬の開発を通じ、人々が健康を維持し、希望を持ち続けることに貢献します」を企業理念として掲げております。この理念のもと、革新的な医薬品の創出に取り組み、持続的な企業成長と社会的価値の向上を実現してまいります。
また当社は、企業理念の実現のために、以下の3つを行動規範として定めております。
- グローバルベンチャーとして挑戦する情熱
- サイエンスの追及
- コンプライアンスの徹底遵守

経営方針
Goals for 2030
当社は、長期的な経営戦略として以下の通り「Goals for 2030」を定め、段階的かつ着実な取組を進めております。
- LAT1阻害剤[(ナンブランラト) First-in-Class]単剤療法での、胆道がん治療薬としてグローバル承認獲得
・日本発のブロックバスター製品(年間売上USD 1B)を目指す - 免疫機構に着目した新たな治療薬の可能性を追究し、がん、自己免疫疾患、希少疾患へと展開
- 次世代LAT1阻害剤(Best-in-Class)の臨床試験入り
- 新たなトランスポーター阻害剤の創出によるパイプライン拡充
- 種々の創薬技術を取り込みプラットフォーム化し、継続的な創薬と事業化の仕組み作り

会社概要
| 社名 | ジェイファーマ株式会社 (英語表記:J-Pharma Co.,Ltd.) |
| 所在地 |
〒105-0013 東京都港区浜松町一丁目10-11 VORT浜松町Ⅱ 8階 TEL: 一般のお問合せ(代表番号)03-6432-4270 FAX: 03-6432-4271 |
| 設立年月日 | 2005年12月26日 |
| 代表者 | 吉武 益広(代表取締役社長) |
| 資本金 | 132百万円(2025年12月現在) |
| 決算期 | 3月31日 |
| 事業内容 | 医薬品の開発 |
| 従業員数 | 18人(2025年12月1日 現在 ) |
アクセスマップ
役員一覧

代表取締役社長
吉武 益広
- 40年の業界経験
- メガファーマにおいて30年以上に渡りグローバル医薬品事業のリーダーシップポジションを歴任し、3つの医薬品のFDA・EMA承認を獲得
- 当社リード化合物の国内フェーズ2に成功。FDAより合意を獲得し、グローバルフェーズ3を開始

取締役CFO
藤本 裕
- 20年の業界経験
- コンサルファーム・メガファーマにおいてグローバルマーケティングを担当
- 創業したスタートアップの価値を200倍に高めファンドに売却
- 当社において累計70億円の資金調達をリード

社外取締役
三浦 泰夫
- 株式会社島津製作所にて経営戦略室長や欧州子会社社長などを歴任。
- 2013年からは同社取締役に就任するとともに、執行役員として営業、理財、リスクマネジメント、最高財務責任者(CFO)などの分野を担当。
- 2023年4月からは同社のエグゼクティブ・アドバイザーを務める。
- 2025年6月に当社社外取締役に就任

社外取締役・監査等委員
森 俊介(薬学博士、薬剤師)

社外取締役・監査等委員
田島 照久(公認会計士)

社外取締役・監査等委員
川口 幸作(弁護士)
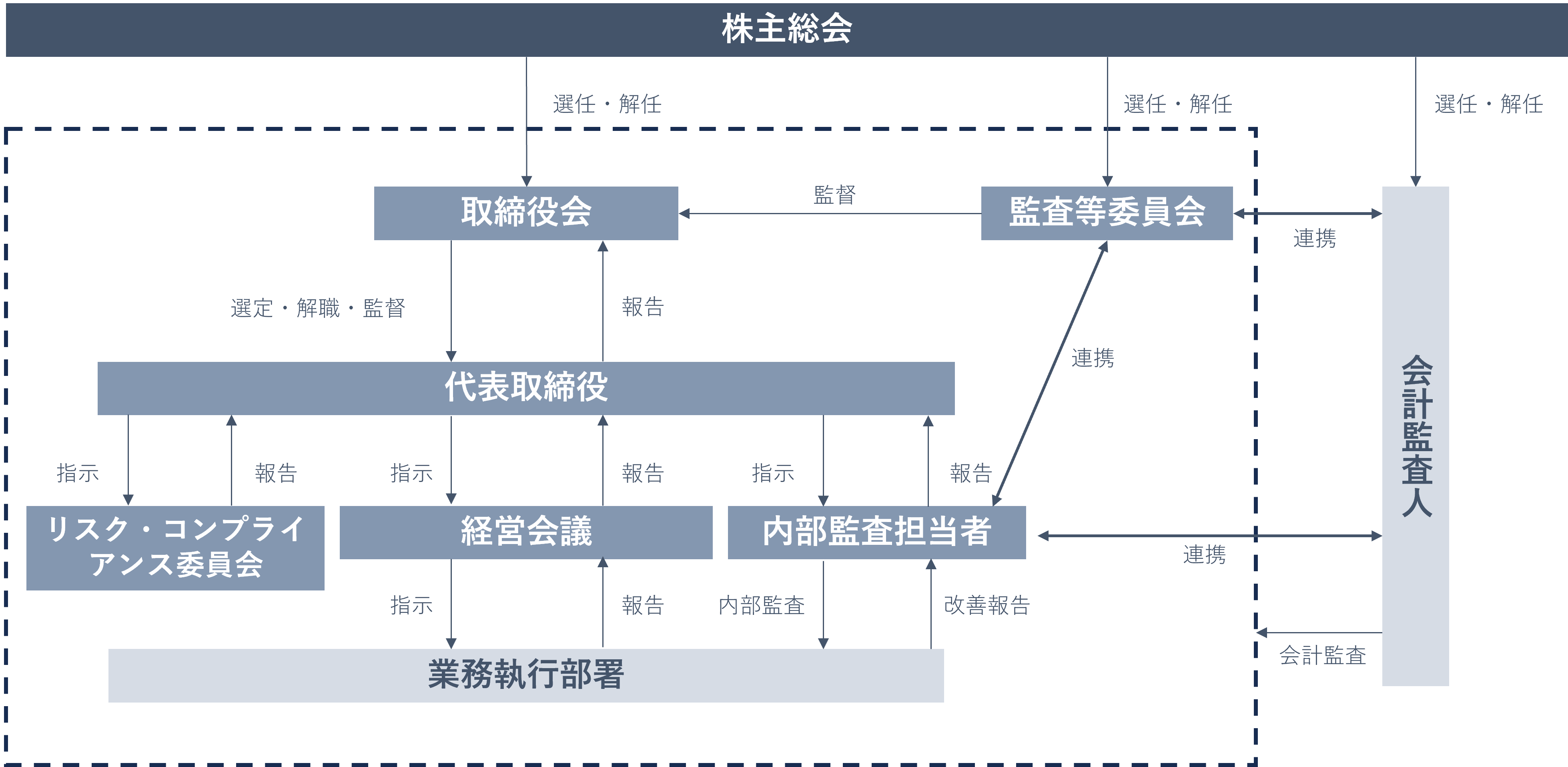
コーポレート・ガバナンス
当社は、株主をはじめとするステークホルダーに対して経営の透明性を確保し、合理的・効率的な経営活動を行うことによって企業価値を継続的に高めることを経営の基本方針としており、事業規模・形態及び経営の効率化等を勘案し、監査等員会設置会社制度を採用しております。
当社のコーポレート・ガバナンス体制の概要は以下のとおりです。
沿革
| 2005年12月 | 細胞膜のトランスポーターに特化した医薬品開発を行う会社としてジェイファーマ株式会社を東京都港区虎ノ門一丁目に設立 |
| 2006年10月 | 医薬基盤研究所 医薬品・医療機器実用化研究支援事業「高リン血症治療薬の開発」採択 |
| 2006年10月 | 東京都新宿区新宿二丁目に本社を移転 |
| 2007年9月 | NEDOイノベーション実用化助成事業「胃硬性がん療法の開発」採択 |
| 2007年10月 | 文部科学省分子イメージング研究プログラム「がん細胞特異膜タンパク質を標的とした新規分子プローブの開発」採択 |
| 2009年8月 | NEDOイノベーション推進事業「新規リン吸着剤JPH101の研究開発事業及び臨床第1相試験の実施」採択 |
| 2010年8月 | NEDO基礎研究から臨床研究への橋渡し促進技術開発/橋渡し促進技術開発「がん細胞に発現する必須アミノ酸トランスポーター(LAT1)を分子標的とする新規抗がん療法の研究開発」に採択 |
| 2013年4月 | NEDOベンチャー実用化助成事業「アミノ酸トランスポーター阻害による革新的抗がん薬の臨床開発」採択 |
| 2013年5月 | 神奈川県横浜市鶴見区に本社を移転 |
| 2013年7月 | 横浜市特区リーディング事業助成金「トリプルネガティブ悪性乳がんの体外診断薬キットの開発」採択 |
| 2014年5月 | NEDOベンチャー実用化助成事業「新規抗がん薬JPH203の臨床試験実施によるPOCの確保」採択 |
| 2014年7月 | 横浜市特区リーディング事業助成金「トリプルネガティブ乳がん用体外診断薬の実用化」採択 |
| 2015年1月 | LAT1阻害剤ナンブランラト(開発コード:JPH203)の国内における第1相臨床試験を開始 |
| 2017年7月 | ナンブランラトの国内における第1相臨床試験を終了 |
| 2018年11月 | ナンブランラトの国内における第2相臨床試験を開始 |
| 2019年4月 | 大原薬品工業株式会社とナンブランラトに係るライセンス及び共同開発に関する契約締結 |
| 2022年4月 | ナンブランラトが米国食品医薬品局(FDA)より進行性胆道がんのオーファンドラッグ(希少性疾患医薬品)に指定 |
| 2022年12月 | ナンブランラトの国内における第2相臨床試験を終了 |
| 2023年10月 | 中枢移行性LAT1阻害剤(開発コード:JPH034)の多発性硬化症に対する開発が、米国National Multiple Sclerosis Society (NMSS) のFast Forward商業化研究助成プログラムに採択され助成金を受領 |
| 2023年10月 | 米国での医薬品開発のための人材採用を目的としてJ-Pharma USAを設立(2025年7月に清算結了) |
| 2024年6月 | JPH034が国立研究開発法人日本医療研究開発機構(AMED)「創薬ベンチャーエコシステム強化事業」に採択 |
| 2024年9月 | ナンブランラトのがん患者に対する臨床試験に向けたInvestigational New Drug (IND) 申請が米国食品医薬品局(FDA)より承認 |
| 2025年5月 | ナンブランラトのCMC(化学・製造・品質管理)について、米国FDAより肯定的な反応を獲得し、米国FDAが求める商業製造スケールでの品質基準を満たしていることを確認 |
| 2025年6月 | 東京都港区浜松町へ本社移転 |
パートナー
ライセンス契約を行う研究機関

(米国)

大阪大学
開発する疾患領域における治療ポテンシャルをさらに明らかにするための研究開発パートナー

(米国)

(米国)

栃木県立がん
センター
センター

(フィンランド)
基礎的な研究を行う、委託/共同研究パートナー

金沢大学

国立健康危機
管理研究機構
管理研究機構

東京慈恵会
医科大学
医科大学

横浜市立大学
